 |
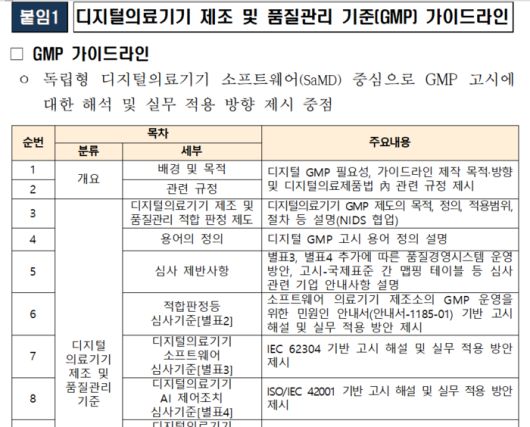
디지털의료기기 제조·품질관리기준(GMP) 가이드라인(자료=식품의약품안전처) |
<이미지를 클릭하시면 크게 보실 수 있습니다> |
이번 디지털의료기기 제조·품질관리기준(GMP) 가이드라인은 지난 4월 제정·시행된 '디지털의료기기 제조 및 품질관리 기준'의 조문별 해석, 업체 환경에 따른 사례별 심사 대상 여부 판단 기준 등 구체적인 사례를 담았다. 소프트웨어(SW)와 인공지능(AI) 기능이 포함된 디지털의료기기에 적용되는 제조·품질관리기준별 작성요령, 고려사항, 품질경영시스템에 종합적으로 적용되는 사례 등을 제공했다.
디지털의료기기 전자적 침해행위 보안 지침 가이드라인 역시 지난 4월 제정·시행된 '디지털의료기기 전자적 침해행위 보안 지침'의 조문별 해설로서 제조업자·의료서비스제공자 등 보안 주체별 시판 전·후 단계의 방향성 제시, 인허가 시 요구사항과 GMP 적용사례 등을 실무 중심으로 내용을 구성했다.
식약처는 지난 10일 정책설명회를 개최하고 400여명의 디지털의료기기 업체·관련 협회 관련자를 대상으로 이번에 제정한 가이드라인 4종에 대한 설명, 인증업무 대행기관의 인허가·GMP 심사 주요 보완사항, 디지털의료제품 규제지원센터 지원 사항·계획 등을 안내했다.
식약처 관계자는 “이번 가이드라인 제정으로 업계의 디지털의료제품법령에 대한 이해도를 높여 신속한 디지털의료기기 제품화에 기여하겠다”면서 “앞으로도 전문성과 규제과학을 기반으로 디지털의료기기 개발을 체계적으로 지원하겠다”고 밝혔다.
송윤섭 기자 sys@etnews.com
[Copyright © 전자신문. 무단전재-재배포금지]
이 기사의 카테고리는 언론사의 분류를 따릅니다.
기사가 속한 카테고리는 언론사가 분류합니다.
언론사는 한 기사를 두 개 이상의 카테고리로 분류할 수 있습니다.
언론사는 한 기사를 두 개 이상의 카테고리로 분류할 수 있습니다.


