미국 FDA 허가는 8건으로 역대 최대 규모
20일 한국제약바이오협회에 따르면 지난해 국내 제약·바이오 기업은 미국 식품의약국(FDA)에서 8건의 품목허가를 획득해 역대 최대 성과를 냈다. 유럽의약품청(EMA)에서는 2건의 품목허가를 받았다.
미국과 유럽을 통틀어 삼성바이오에피스 3건, 셀트리온 2건, 대웅제약 2건(동일 품목 미국·유럽 각각 허가), SK바이오팜 2건, SK케미칼 1건 등 총 10건이다.
특히 미국에서는 바이오의약품과 바이오시밀러, 합성의약품 신약과 합성의약품 복제약 등 전 분야에서 성과가 나왔다.
지난해 1월 삼성바이오에피스의 항암 바이오시밀러(바이오의약품 복제약) '온트루잔트'(국내 제품명 삼페넷)를 시작으로 2월 대웅제약 보툴리눔 톡신 제제 '주보'(국내 제품명 나보타), 3월 SK바이오팜의 합성의약품 신약 '수노시'의 허가가 이어졌다.
4월에는 셀트리온이 슈퍼 항생제 '리네졸리드', 삼성바이오에피스가 바이오시밀러 '에티코보'를 각각 허가받았다. 삼성바이오에피스는 7월에 바이오시밀러 '하드리마'의 허가를 추가했다.
이어 11월에는 SK바이오팜이 후보물질 발굴부터 임상, 허가까지 독자적으로 진행한 뇌전증 합성신약 '엑스코프리'로 미국 FDA 문턱을 넘었다. SK케미칼은 자체 개발한 붙이는 치매 치료제의 품목허가를 받았다. 국내 제약사가 개발한 패치(PATCH)형 치매 치료제가 FDA 승인을 받은 건 이번이 처음이다.
유럽에서는 대웅제약이 보툴리눔 톡신 제제 '누시바'(국내 제품명 나보타)를 EMA에서 허가받았다. 대웅제약은 자체 개발한 보툴리눔 톡신 제제로 지난해 미국과 유럽에서 모두 허가를 획득하는 성과를 거뒀다.
11월에는 셀트리온이 기존 램시마를 피하주사형으로 만든 '램시마SC'의 EMA 허가를 추가했다.
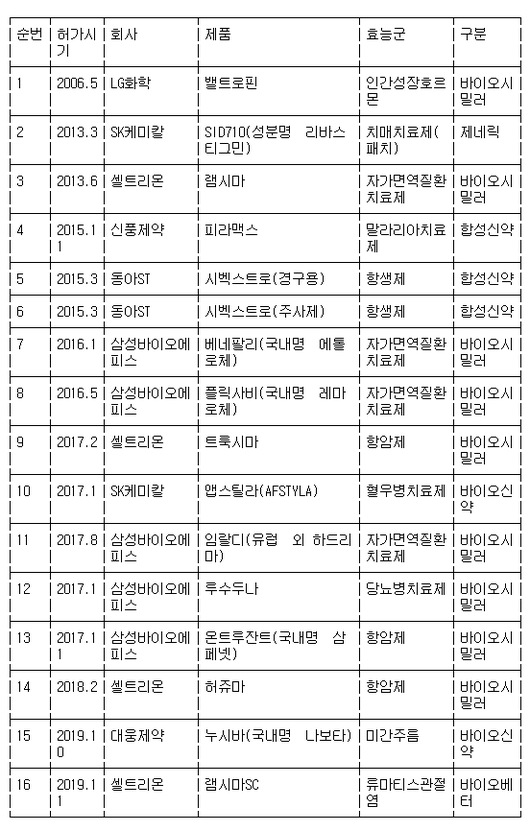
이달 기준 국내서 개발한 의약품의 미국 FDA 허가는 총 23건, EMA는 총 16건으로 집계됐다.
[표1] 국내 제약·바이오산업 미국 식품의약국(FDA) 의약품 승인 현황
 |
<이미지를 클릭하시면 크게 보실 수 있습니다> |
※ 한국제약바이오협회 제공(*한미약품 '히알루마'는 전문의약품이지만 2018년 5월 FDA에서 의료기기로 허가)
[표2] 국내 제약·바이오산업 유럽의약품청(EMA) 의약품 승인 현황
 |
<이미지를 클릭하시면 크게 보실 수 있습니다> |
※ 한국제약바이오협회 제공(*삼성바이오에피스 루수두나는 2018년 MSD가 상업화 포기,
*JW생명과학 피노멜주(국내명 위너프)는 EMA 허가받지 않고 유럽 각국의 개별 허가 취득 후 2019년 7월 제품 출시)
jandi@yna.co.kr
<저작권자(c) 연합뉴스, 무단 전재-재배포 금지>
이 기사의 카테고리는 언론사의 분류를 따릅니다.
기사가 속한 카테고리는 언론사가 분류합니다.
언론사는 한 기사를 두 개 이상의 카테고리로 분류할 수 있습니다.
언론사는 한 기사를 두 개 이상의 카테고리로 분류할 수 있습니다.


