독일 뮌헨공대 연구진 보고서
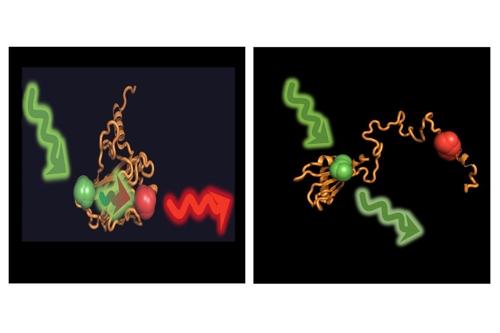 |
왼쪽은 접힌 상태 p53/오른쪽은 샤프론의 유도로 접히지 않은 상태. |
(서울=연합뉴스) 한기천 기자 = p53는 17번째 염색체에 있는 대표적인 항암 유전자다. 세포 유전체의 손상이 감지되면 p53는 세포의 이상 증식을 억제하고 자멸사를 유도한다. 유방암, 난소암 등 유전성 암은 거의 모두 돌연변이를 일으킨 p53가 제 기능을 못 해 생긴다.
이런 p53가 일명 '샤프론(chaperone) 단백질'의 철저한 제어를 받아 발현한다는 걸 독일 뮌헨공대(TUM) 과학자들이 밝혀냈다. 샤프론 단백질이 '오케이 사인'을 주지 않으면 p53가 정상 기능을 하지 못한다는 얘기다.
TUM의 요하네스 부흐너 생명공학 교수팀은 이런 내용의 연구보고서를 저널 '몰레큘러 셀(Molecular Cell)' 최근호에 발표했다.
21일(현지시간) 온라인(www.eurekalert.org)에 공개된 연구 개요에 따르면 '분자 샤프론(molecular chaperone)'으로 불리기도 하는 샤프론 단백질은, 다른 단백질이 올바르게 접혀 제 기능을 발휘하게 제어한다.
연구팀은 두 그룹으로 나뉜 샤프론 단백질이 p53의 3차원 구조에 영향을 미침으로써 그 기능을 제어한다는 걸 입증했다. Hsp70 샤프론과 Hsp40 샤프론이 한 그룹을, Hsp90 샤프론이 다른 그룹을 형성했다.
연구팀은 실험 도중 분자 구조를 관찰할 수 있게 p53를 형광 염료로 표시했다.
p53가 포함된 시험관 용액에 Hsp70·Hsp40 샤프론을 첨가했더니 p53는 DNA와 결합하는 능력을 상실했다. 이는 p53의 생리학적 활동이 중단됐다는 의미다.
샤프론과 떨어져 있을 때 p53 단백질은 혼자서도 접혔다. 그런데 Hsp70·Hsp40의 영향을 받을 땐 에너지를 쓰면서도 전혀 접히지 않았다.
반면 같은 시험관 용액에 Hsp90 샤프론을 추가하면 p53가 다시 접히면서 기능을 회복했다.
부흐너 교수는 "샤프론 단백질의 엄청난 영향력에 많이 놀랐다"면서 "세포 안엔, 샤프론 단백질이 종양 억제 단백질의 이탈을 막기 위해 사용하는 복잡한 조절 메커니즘이 있다"고 말했다.
이런 분자 간 상호작용을 이해하면 장차 단백질 기능에 대해 더 많이 알게 되고, 암 치료법의 새로운 공격 포인트를 찾는 데도 도움이 될 것으로 연구팀은 기대한다.
cheon@yna.co.kr
<저작권자(c) 연합뉴스, 무단 전재-재배포 금지>
이 기사의 카테고리는 언론사의 분류를 따릅니다.
기사가 속한 카테고리는 언론사가 분류합니다.
언론사는 한 기사를 두 개 이상의 카테고리로 분류할 수 있습니다.
언론사는 한 기사를 두 개 이상의 카테고리로 분류할 수 있습니다.


