식약처, 라니티딘 사용 의약품 NDMA 안전성 조사 실시
식약처는 잔탁 생산 1개 제조소 외에 나머지 10개 제조소에 대한 수거·검사를 확대할 계획이다.
16일 식약처에 따르면 식약처는 미국FDA와 유럽의약품청(EMA)이 지난 14일(현지기준) 글락소스미스클라인(GSK)의 잔탁에서 NDMA가 검출됐다는 위해정보를 입수하고 15일 조사에 돌입했다.
NDMA는 세계보건기구 국제 암연구소(IARC)가 발암물질로 작용할 가능성이 있는 ‘2A 물질’로 분류하고 있다. 라니티딘은 위산과다, 속쓰림, 위·십이지장궤양, 역류성식도염 등에 사용하는 의약품이다.
식약처는 FDA가 미량 검출됐다고 발표한 라니티딘 제품중 일단 대표 품목인 GSK의 ‘잔탁’ 3개품목의 제조번호별 29개제품과 잔탁에 사용된 원료 라니티딘(6개) 등 총 35개를 긴급하게 수거·검사 했다.
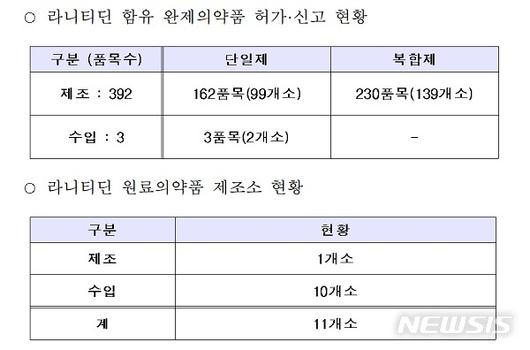
‘라니티딘’ 원료의약품 제조소 11곳 중 ‘잔탁’ 생산 1개 제조소 제품을 조사한 결과 NDMA가 불검출됐다.
향후 식약처는 나머지 10개소에서 생산·유통 중인 원료의약품에 대해서도 수거·검사할 계획이다.
그 결과에 따라 완제의약품에 대해서도 단계적으로 검사를 실시할 계획이다.
 |
<이미지를 클릭하시면 크게 보실 수 있습니다> |
식약처는 “미국 FDA 및 유럽 EMA에서는 일부 라니티딘 함유 제제에서 낮은 수준(low level)의 NDMA가 검출됐기 때문에 회수 등 조치는 하고 있지 않은 상황이며, 지속적으로 안전성을 조사할 예정이라고 밝혔다”고 설명했다.
이어 “FDA·유럽의약품청·캐나다의약품청에서는 환자들에게 복용을 중지하지는 말라고 권고하고, 처방을 변경하고자 하는 경우는 전문가와 상담하고, 일반의약품으로 라니티딘을 복용 중인 환자는 시중에 많이 있는 동일 효능의 다른 제품들을 사용할 수 있을 것임을 밝히고 있다”고 제언했다.
한편, 라니티딘을 함유한 완제의약품 전 품목은 복합제와 단일제 포함해 395개 품목이다.
2018년 수입 및 생산실적 기준으로 위장병(소화성궤양) 치료제는 약 1조511억원이며, 이 중 라니티딘 함유 의약품은 2664억원으로 25.3%를 차지한다. 잔탁 3개 품목의 수입실적은 6180만원(2018년 기준)이다.
songyj@newsis.com
▶ 뉴시스 빅데이터 MSI 주가시세표 바로가기
▶ 뉴시스 SNS [페이스북] [트위터]
<저작권자ⓒ 공감언론 뉴시스통신사. 무단전재-재배포 금지.>
이 기사의 카테고리는 언론사의 분류를 따릅니다.
기사가 속한 카테고리는 언론사가 분류합니다.
언론사는 한 기사를 두 개 이상의 카테고리로 분류할 수 있습니다.
언론사는 한 기사를 두 개 이상의 카테고리로 분류할 수 있습니다.


