경구용 알츠하이머치료제 AR1001, FDA 임상 2상 성공
최근에는 혈관성치매, 경도 인지 손상으로 적응증 확대 중
추가적인 치매 신약 후보물질 3개 더 있어
정재준 대표 “누구도 정복 못한 질병 치매, 큰 시장 노릴 것"
2010년 설립된 당시 아리바이오가 갖고 있던 후보물질로 지금까지 개발을 진행하는 것은 3가지다. 바로 지난 3월 미국에서 임상 2상을 완료한 세계 최초 경구용 알츠하이머치료제 ‘AR1001’과 폐혈증치료제 ‘AR2001(전임상 완료)’, 비만치료제 ‘AR3001(임상 1상 완료)’ 등이다. 최근 아리바이오는 치매 신약 개발에 집중하기 위해 AR2001과 AR3001의 개발을 잠정 중단하기로 한 상태다.
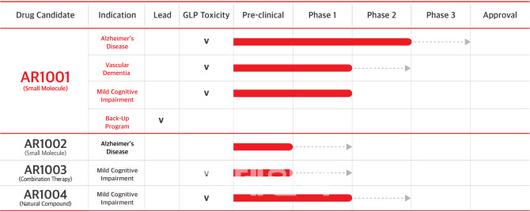 |
아리바이오의 치매 및 신경 손상 관련 신약후보 물질은 현재까지 총 4개로 가장 대표적인 것이 2021년 3월 미국에서 임상 2상에 성공한 경구용 알츠하이머치료제 ‘AR1001’이다. 이밖에도 AR1002(전임상 완료), AR1003(전임상 완료), AR1004(임상 1상 완료)등이 치매 신약후보 물질로 개발되고 있다. (제공=아리바이오) |
<이미지를 클릭하시면 크게 보실 수 있습니다> |
경구용 알츠하이머 치료제 AR1001, 다중표적 방식으로 승부
치매를 크게 알츠하이머와 혈관성 치매, 파킨슨병, 기타 불분명한 치매 등 네 가지로 구분한다. 아리바이오의 주력 물질인 AR1001은 치매 중 알츠하이머를 치료하기 위해 설계됐다. PD5와 글루코코이드 등 두 가지 뇌 속 물질을 표적으로 하는 다중표적 약물이다. 이번 임상 2상에서 알츠하이머 환자의 인지 기능 악화 속도를 지연시키는 효과가 큰 것으로 확인됐다.
정재준 아리바이오 대표는 “단일표적이나 다중표적이 치매 연구에서 어떤 의미인지부터 명확히 알아야 한다”며 “치매를 바라보는 관점이 완전히 다르기 때문”이라고 설명했다.
치매에 관한 연구가 본격화되던 2000년대 초반 학계에서는 뇌 속에서 발견된 ‘아밀로이드베타(Aβ)’가 치매의 핵심 원인으로 떠올랐다. 현재도 많은 글로벌 제약사가 Aβ를 공격하는 단일표적 약물을 개발 중이다. 대표적인 것이 지난 6월 세계 최초로 미국식품의약국(FDA)의 승인을 받아 시판된 미국 제약사 바이오젠의 ‘아두헬름(성분명 아두카두맙)’이다. 참고로 아두헬름은 인지기능 개선 효과를 증명하지 못한 채 허가를 받았다는 학계의 질타를 받고 있다. Aβ를 없애는 효과가 큰 약물에서 흔한 부작용인 뇌부종으로 아두헬름을 처방받은 환자의 사망사고가 보고돼 논란이 일고 있다.
이와 달리 현재 학계에서는 치매에 대해 다양한 문제가 복합적으로 작용해 뇌의 시스템을 망가뜨린 결과로 설명한다. 여기에는 치매 발병 초기부터 쌓이는 아밀로이드베타(Aβ)와 중·후기부터 두드러지게 나타나 신경세포들을 뭉쳐서 죽게 만드는 단백질인 타우(tau), 독성을 가진 활성산소의 증가 등이 작용하게 된다.
정 대표는 “Aβ나 타우, 활성산소는 정상인에서도 발생하는 물질이지만, 치매환자에서는 이런 물질들이 제대로 처리되지 않아 문제를 일으키는 것”이라며 “AR1001이 표적으로 하는 PD5와 글루코코이드는 이 세 가지 물질을 없애는 다양한 생체기전에 모두 관여해 효과를 띠는 것”이라고 설명했다.
“AR1001 발판 삼아 치매 신약후보 물질 3개 더 확보”
AR1001은 알츠하이머 관련 FDA의 임상 2상에서 210명을 10mg 투약군, 30mg 투약군, 위약군(대조군)으로 나눠 1일 1회씩 약물을 투입했다. 이 임상시험 결과, 인지기능 평가 지표(ADAS-Cog 13) 개선, 안전성과 내약성을 인정받았다.
또 AR1001은 혈관성 치매와 경도 인지 손상 등의 추가 적응증과 관련해서도 모두 임상 1상을 완료한 상황이다. 혈관성 치매는 뇌경색이나 뇌졸중 등 혈관질환의 발병 후 주로 5년 내로 나타나는 치매이며, 경도 인지 손상은 인지 기능이 저하되지만 일상생활은 가능한 신경 질환이다.
정 대표는 “AR1001은 여러 표적에 강하게 작용하지 않기 때문에 문제가 될만한 부작용이 확인되지 않았다”며 “다른 치매나 인지기능 관련 질병으로도 적응증을 확대하고 있다”고 말했다.
그렇다면 아리바이오가 AR1001을 경구용으로 개발한 이유는 무엇일까. 치매치료제 역시 경구용과 주사제로 나뉜다. 치매는 생명과 직결되지 않고 발병 이후에도 일정 기간 삶이 지속하는 특징이 있다. 초기 치매 환자나 중증이라도 약을 스스로 먹을 수 있는 환자라면 가볍게 삼킬 수 있는 경구용 치료제가 개발돼야 좋다. 하지만 약을 삼키는 것이 어려운 환자라면 주사제가 필요하다.
아리바이오는 폭넓은 환자가 오래 사용할 수 있도록 AR1001을 우선 경구용으로 개발했고, 향후 제형을 바꾸는 걸 시도할 예정이다. 현재는 AR1001의 알츠하이머 관련 미국 임상 3상을 진행하기 위해 회의를 준비하고 있다. 자체적으로 마련한 초안에 따르면 미국과 유럽, 한국의 환자를 대상으로 약 3년 동안 시행할 계획이다.
한편 아리바이오는 AR1002(알츠하이머용, 전임상 완료), AR1003(경도 인지 손상용, 전임상 완료), AR1004(경도 인지 손상용, 임상 1상 완료) 등 치매 관련 파이프라인을 늘려나가고 있다. 정 대표는 “AR1001의 효과와 안전성이 검증됐기 때문에, 이를 바탕으로 생물학적 또는 화학적 방식으로 구조를 일부 수정해 추가 신약후보 물질을 만들 수 있다”며 “치매를 비롯한 난치성 신경 질환에 적용할 수 있는 파이프라인을 확보해 지속해서 개발할 것”이라고 말했다.
 |
정재준 아리바이오 대표가 한 연구원과 신약후보 물질의 평가 결과에 대해 이야기하고 있다.(제공=아리바이오) |
<이미지를 클릭하시면 크게 보실 수 있습니다> |
치매치료제 임상 3상만 41건...아두헬름까지 모두가 경쟁사
지난 9월 한국제약바이오협회가 주관한 2021 치매치료제 연구개발 동향 및 지원 방안 세미나‘에 따르면 알츠하이머 치료용 약물은 126개로 156건의 임상시험이 진행 중이다. 이 중 28개 약제가 41건의 임상 3상을 진행하고 있다.
국내에서는 메디포스트(078160)가 뇌실에 투여하는 방식으로 개발 중인 줄기세포 기반 알츠하이머 치료제 ‘뉴로스템’이 식품의약품안전처의 임상 1/2a상을 마친 상태다. 젬백스앤카엘의 치매치료제 GV1001은 식약처의 임상 3상 계획을 승인받기 위해 준비 중인 것으로 알려졌다.
그는 “일일이 나열할 수 없지만 이미 시판된 아두헬름을 비롯해서 우리처럼 신약 개발의 마지막 관문으로 달려가는 곳이라면 모두 우리가 마주해야 할 경쟁사”라며 “아직 어떤 글로벌 제약사도 시장을 장악하지 못했기 때문에 기회는 누구에게나 열려 있다”고 말했다.
이 기사의 카테고리는 언론사의 분류를 따릅니다.
기사가 속한 카테고리는 언론사가 분류합니다.
언론사는 한 기사를 두 개 이상의 카테고리로 분류할 수 있습니다.
언론사는 한 기사를 두 개 이상의 카테고리로 분류할 수 있습니다.


