 |
<이미지를 클릭하시면 크게 보실 수 있습니다> |
코오롱티슈진이 개발한 골관절염 세포유전자치료제 '인보사(미국 프로젝트명 TG-C)'가 미국에서 임상 3상이 중단된 지 2년 만에 3상 등록 환자에 대한 투약을 재개했다. 인보사는 국내에서는 주성분이 바뀌었다는 이유로 2019년 식품의약품안전처가 품목허가를 취소했던 약이다. 한국에서 사실상 퇴출된 것과 달리 미국 식품의약국(FDA)에서는 인보사의 가능성을 높게 보고 자국 시장의 문을 열어줬다는 평이 나온다.
28일 코오롱티슈진은 "27일(현지시간) 미국 캘리포니아주 샌타모니카의 소스헬스케어병원에서 임상환자 투약을 재개했다"며 "미국 전역에 있는 약 80개 임상 기관에서 총 1020명(기임상 완료자 11명 포함)의 환자에 대한 투약을 2023년까지 완료할 계획"이라고 밝혔다.
코오롱티슈진에 따르면 임상 3상에 참여하는 팀들은 마운트시나이병원, 뉴욕대병원, 로스먼 오소페딕 등 미국 내에서 골관절염 치료의 중추적 기능을 해 온 80개 대학병원과 전문클리닉 의료진으로 구성됐다. 한성수 코오롱티슈진 대표는 "임상을 성공적으로 완수해 미국뿐만 아니라 세계 골관절염 시장에서 게임 체인저로 자리 잡을 수 있게 하겠다"고 말했다.
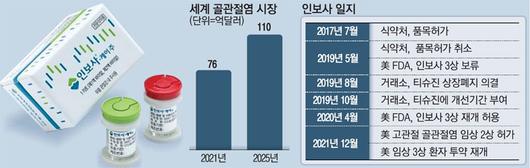
인보사는 기존 무릎 골관절염 치료 방법인 수술법과 마약성 진통제, 물리치료 방법 등과는 달리 무릎 관절강에 직접 약물을 주입하는 주사제 형태 신약이다. 코오롱티슈진은 인보사가 통증 조절과 기능 개선을 넘어 관절 구조의 개선 효과까지 얻을 수 있는 근본적 치료제(DMOAD)로 승인받을 수 있도록 임상을 설계했다. 세계적으로 DMOAD로 인정받은 치료제는 아직 없다. 인보사는 2017년 7월 식약처에서 품목허가를 받았지만 2019년 5월 품목허가 취소라는 철퇴를 맞은 바 있다. 당시 코오롱생명과학 임원들이 당국에 허위 서류를 냈다는 이유 때문이었다. 실제 코오롱 측이 제출한 자료에 적힌 것은 연골세포가 아니라 신장유래세포가 포함된 것으로 드러났는데, 이에 대해 코오롱 측은 개발 당시 착오가 있었고 안전성과 유효성에는 문제가 없다고 주장해왔다. 이에 식약처를 상대로 허가 취소처분 취소 소송을 제기했으나 지난 2월 1심에서 패소하면서 항소 절차를 밟고 있다.
이 같은 이슈의 여파로 FDA 역시 2019년 5월 미국 내 인보사 임상 3상을 중단했지만 올 들어 분위기가 사뭇 달라지고 있다. 작년 4월 FDA에서 임상 재개 허가를 받고, 이달 3일 또 다른 적응증인 고관절 골관절염 환자에게 별도 임상 2상까지 허가받은 데 이어 28일 임상 3상 환자 투약 재개를 마침내 공식화했기 때문이다. 애초 인보사가 안전성 논란 때문에 2019년 국내 품목허가 취소 처분을 받은 반면, 미국 전문가들은 '인보사가 안전하다'고 평가한 것으로 풀이된다.
제약·바이오 업계에서는 미국 내 임상 재개 소식 등이 코오롱티슈진의 한국거래소 상장폐지 절차에도 영향을 미칠 것으로 보고 있다. 한국거래소는 2019년 기업심사위원회(기심위)를 열고 코오롱티슈진이 심사 당시 중요 사항을 허위 기재했거나 누락했다고 판단해 상장폐지를 의결했다. 그러나 3심 격인 코스닥시장위원회는 FDA가 인보사 임상 3상 재개를 허용할 가능성이 높다고 판단해 지난 8월 개선 기간을 부여했다. 제약·바이오 업계 관계자는 "FDA의 임상 재개 허용은 논란이 됐던 인보사의 안전성·유효성에 큰 문제가 없다는 의미로 해석될 수 있다"며 "내년 2월 열리는 코스닥시장위원회 결과를 잘 지켜볼 필요가 있다"고 밝혔다.
일각에서는 코오롱 측이 인보사의 국내 품목허가 취소처분 취소 소송에서 최종 패소하고 상장폐지까지 이뤄지더라도 미국 임상 결과가 좋으면 인보사의 세계 시장 진출에 탄력이 붙을 것으로 전망하고 있다.
[김시균 기자]
[ⓒ 매일경제 & mk.co.kr, 무단전재 및 재배포 금지]
이 기사의 카테고리는 언론사의 분류를 따릅니다.
기사가 속한 카테고리는 언론사가 분류합니다.
언론사는 한 기사를 두 개 이상의 카테고리로 분류할 수 있습니다.
언론사는 한 기사를 두 개 이상의 카테고리로 분류할 수 있습니다.


