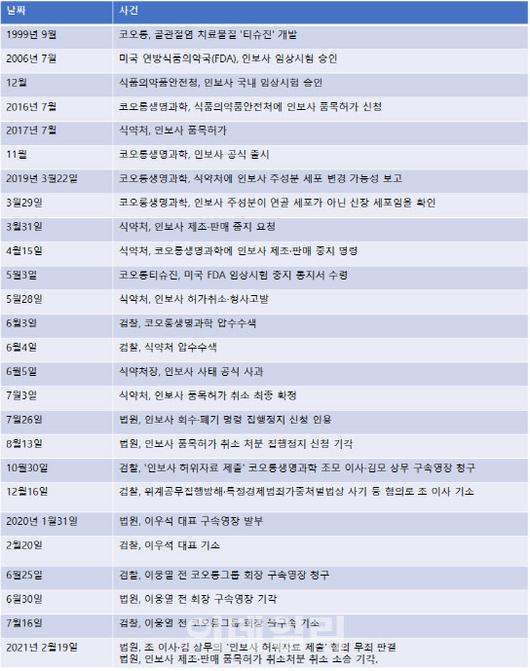
기구한 세계 최초 골관절염 세포유전자 치료제 역사
 |
(자료=업계) |
<이미지를 클릭하시면 크게 보실 수 있습니다> |
[이데일리 노희준 기자] ‘성분 뒤바뀜’ 논란으로 취소 처분을 받은 코오롱생명과학(102940)의 골관절염치료제 인보사케이주(인보사)에 대한 식품의약품안전처 처분이 정당하다는 법원의 판단이 나왔다. 아직 항소 입장을 명확히 밝히지 않은 코오롱생명과학이지만 사실상 회사의 유일한 제품이기 때문에 향후 법적 다툼을 계속 벌여나갈 것으로 보인다.
코오롱생명과학은 2017년 7월 인보사에 대한 허가를 식약처에서 받았다. 세계 첫 골관절염 세포유전자 치료제이자 국산 신약 29호 타이틀이 회사에 부여됐다. 당시만 해도 업계나 식약처 모두 세계 최초 타이틀 제품으로 대대적으로 인보사를 주목했다.
코오롱생명과학은 그해 11월 인보사를 공식 출시하고 일본 제약업체와 기술수출 계약을 맺어 해외 진출에도 탄력을 받는듯 보였다. 하지만 2019년 3월 치료제 주성분 가운데 하나(2액)가 허가 당시 서류에 기재된 연골세포가 아니라 종양 유발 가능성이 있는 신장 세포라는 사실이 드러나 파문을 일으켰다. 이 치료제는 사람 연골세포가 담긴 1액과 연골세포 성장인자를 도입한 형질 전환 세포가 담긴 2액으로 구성돼 있다.
식약처는 2019년 3월 인보사에 대한 제조·판매 중지 요청을 내렸고 5월에는 인보사 허가취소·형사고발에 나섰다. 대대적인 인보사 띄우기에 앞장섰던 식약처 역시 ‘부실 심사 및 허가’ 비판을 피하지 못했다. 당시 식약처장이었던 이의경 처장은 그해 6월에 ‘인보사 사태’에 대한 공식 사과를 해야 했다. 식약처 역시 특혜 의혹 논란에 휩싸여 검찰의 압수수색을 받아야 했다.
코오롱생명과학과 식약처의 법적 다툼은 식약처가 2019년 7월 인보사의 품목허가를 최종 취소하면서 본격적으로 시작됐다. 인보사를 투여받은 240여명의 환자와 300명에 달하는 주주들은 회사를 상대로 손해배상청구소송에 나서면서 회사를 압박했다. 검찰 역시 압수수사 등 대대적 수사를 벌여 2020년 2월 이우석 코오롱생명과학 대표를 법정에 넘기고 7월에는 이웅렬 전 코오그룹 회장을 불구속 기소하는 등 코오롱 임직원에 대해서도 칼끝을 겨눴다.
품목허가 취소와 사정당국의 전방위적 압박으로 코오롱생명과학에 전반적으로 불리하게 돌아가던 분위기는 지난해 4월 미국 식품의약국(FDA)이 인보사의 임상 3상을 재개하면서 반전되기 시작했다. FDA에서 임상을 진행해도 문제가 없다고 판단한 만큼 식약처의 취소처분 취소 소송에서 반전을 꾀할 수 있을 것이라는 기대가 있어서다.
여기에 이날 오전 이뤄진 관련 형사재판에서 인보사 성분 조작 혐의로 기소된 코오롱생명과학 임원들이 무죄를 선고받으며 코오롱생명과학이 반전의 불씨를 살리는듯 보였다. 하지만 이날 행정재판에서 회사측의 기대와 달리 식약처 처분이 정당하다는 판결을 내렸다. 박재우 코오롱생명과학 측 변호사는 이날 기자와의 통화에서 “판결문은 다음주 월요일 정도 받아볼 수 있을 것으로 보여 양쪽(형사법원, 행정법원)을 대조분석한 다음 향후 대응 방안을 결정하겠다”고 말을 아꼈다.
 |
이 기사의 카테고리는 언론사의 분류를 따릅니다.
기사가 속한 카테고리는 언론사가 분류합니다.
언론사는 한 기사를 두 개 이상의 카테고리로 분류할 수 있습니다.
언론사는 한 기사를 두 개 이상의 카테고리로 분류할 수 있습니다.


