이 기사는 2024년01월17일 09시32분에 팜이데일리 프리미엄 콘텐츠로 선공개 되었습니다.
[이데일리 김진호 기자] 미국에서 정식 승인된 알츠하이머(치매) 치료제 ‘레켐비’(성분명 레카네맙)는 일본에 이어 지난 9일 중국에서도 승인을 받았다. 레켐비는 이르면 연내 국내에도 도입될 전망이다. 20년간 개발 실패로 점철됐던 치매 치료 시장에 등장한 레켐비가 후발주자들에게도 희망을 던지고 있다는 평가다.
16일 팜이데일리는 치매 치료제를 개발하고 있는 K바이오를 집중 분석해봤다. 아리바이오와 젬백스(082270)앤카엘, 엔케이맥스(182400) 등이 글로벌 임상을 주도하면서 이 분야 선두주자로 꼽힌다. 동아에스티(170900)나 이수앱지스도 새로운 기전의 후보물질을 확보해 임상 진입을 앞두고 있다. 하지만 메디포스트(078160)나 대화제약(067080) 등 치매 신약 관련 개발에 실패한 기업이 꾸준히 나오고 있는 만큼 국내 개발 동향을 면밀히 파악해 투자를 이어가야 한다는 의견이 나온다.
 |
(제공=게티이미지) |
치매 임상 진입 K-제약바이오 18곳...5곳은 개발 포기
이날 팜이데일리의 취재를 종합하면 최근까지 경도인지장애나 알츠하이머 대상 신약 후보물질을 발굴해 1개 국가 이상에서 임상 단계에 진입한 국내 기업은 총 18곳이다.
여기에는 아리바이오, 젬백스앤카엘, 디앤디파마텍, 엔케이맥스(182400), 이연제약(102460), 브이티바이오, 지투지바이오, 지엔티파마, 메디프론(065650), 메디헬프라인, 비욘드바이오, 차바이오텍, 메디포스트, 일동제약(249420), 환인제약(016580), 대화제약, 광동제약(009290), SK케미칼(285130) 등이 포함된다.
최근까지 이중 5곳의 기업이 단계별 임상 문턱에서 고배를 맛봤다. 일동제약과 환인제약, SK케미칼 등은 각각 천연물 기반 물질로 국내에서 임상 3상까지 진행했지만 결국 실패했다. 대화제약 역시 지난해 6월 천연물성 치매 신약 후보였던 ‘DHP1401’의 임상 2상에서 1차 평가 지표를 충족하지 못했다고 공표했다.
메디포스트의 ‘뉴로스템’은 2018년 미국 내 알츠하이머 임상 1/2a상에 진입한 줄기세포 기반 후보물질이었다. 하지만 이 물질은 효능 미충족으로 2022년 개발 중단됐다. 차바이오텍 역시 줄기세포 기반 정맥주사 방식의 신약 후보물질 ‘CB-AC-02’를 알츠하이머병 치료제로 국내 임상 1/2상을 진행했다. 하지만 현재 다른 주력 후보물질 개발로 인해 CB-AC-02 개발은 후순위로 밀려난 것으로 확인됐다.
아리바이오 필두, 글로벌 임상개발사 3곳 건재
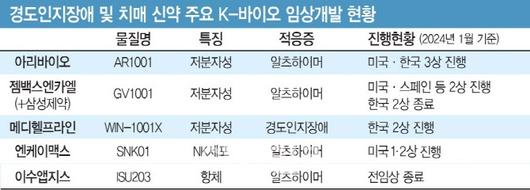
국내사 중 치매 신약 개발업계를 뒤흔들고 있는 곳은 아리바이오다. 회사는 경구용 신약 후보물질 ‘AR1001’에 대해 2022년 말부터 미국 내 3상 투약을 개시했다. 한국에서도 3상 환자를 모집 중이다. AR1001은 PD5와 글루코코이드 등 두 가지 뇌 속 물질을 타깃하는 다중 기전을 가진 것으로 알려졌다.
지난해 아리바이오는 중국과 영국, 유럽연합 7개국 등에서도 AR1001의 임상 3상 시험 신청을 완료하며, 글로벌 개발 범위를 크게 확장했다. 회사에 따르면 현재 AR1001의 중국 내 판권 이전 계약 체결이 임박한 것으로 확인됐다. 아리바이오 측은 “경구제 중 AR1001보다 1년 반 먼저 미국 내 3상에 진입한 카사바사이언스의 ‘시무필람’ 대비 자사 물질의 효능이 우수하다”며 글로벌 개발에 대한 자신감을 드러냈다.
이밖에도 젬백스앤카엘과 엔케이맥스 등도 치매 신약 후보의 글로벌 임상 개발을 이어가고 있다. 젬백스앤카엘은 미국과 스페인 등에서 저분자성 치매 신약 후보 ‘GV1001’ 임상 2상을 진행 중이다. 해당 물질의 국내 개발은 삼성제약이 진행하고 있다.
엔케이맥스의 NK세포 치료제 ‘SNK01’도 지난 2022년 11월 알츠하이머 환자 대상 미국에서 동정적 사용승인을 획득됐다. 동정적 사용승인은 달리 치료제가 없는 환자에게 시판 전 약물을 사용할 수 있도록 기회를 제공하는 제도다. 같은해 10월 멕시코에서 완료된 SNK01의 1상 결과, 독성이 없는데다 약물을 투여한 10명 중 90%에서 치료 효과가 나타난 것으로 분석됐다. 회사는 SNK01의 미국 내 임상 1/2상을 지난해 10월 승인받기도 했다.
 |
(그래픽=이데일리 문승용 기자) |
<이미지를 클릭하시면 크게 보실 수 있습니다> |
‘메디헬프라인·동아에스티·이수앱지스’ 신규 기전 저분자약 개발도
메디헬프라인은 지난해 1월부터 천연물 기반 후보물질 ‘WIN-1001X’로 치매 이전 단계인 경도인지장애 대상 임상 2상을 수행하는 중이다. WIN-1001X는 아세틸콜린 분해 효소 억제 기전과 오토파지를 활성화해 신경세포를 보호하는 기전 등을 동시에 가진 것으로 알려졌다.
동아에스티는 저분자 화합물 기반 DA-7503의 전임상을 수행 중이며, 이수앱지스도 지난해 11월 항체 기반 ISU203의 전임상을 완료한 것으로 알려졌다. DA-7503은 치매의 또다른 원인물질인 타우 단백질 억제하며, ISU203은 아밀로이드베타와 타우를 모두 제거하는 것으로 분석됐다.
증권업계 한 관계자는 “제약바이오 기업 투자에 있어 가장 유의해야 할 이슈가 퇴행성 뇌질환 신약개발일 것”이라며 “효과나 임상 단계별 주목도가 높고, 상장된 기업이라면 확실한 주가 상승요인이다”고 말했다.
그는 이어 “아밀로이드베타라는 원인물질이 학계에서 제기된 다음, 20여 년간 수많은 물질이 개발에 실패했다. 상용화된 레켐비와 각국에서 허가 신청 작업이 이뤄지는 일라이릴리의 ‘도나네맙’만이 살아남았다”며 “뇌전달 플랫폼을 활용하거나 새롭게 규명된 치매 원인들을 동시에 막는 약물로 국내외 개발사가 임상에 나서고 있다. 무엇이 살아남을지 그 과정을 지켜보는 수밖에 없다”고 말했다.
이 기사의 카테고리는 언론사의 분류를 따릅니다.
기사가 속한 카테고리는 언론사가 분류합니다.
언론사는 한 기사를 두 개 이상의 카테고리로 분류할 수 있습니다.
언론사는 한 기사를 두 개 이상의 카테고리로 분류할 수 있습니다.


