 |
<이미지를 클릭하시면 크게 보실 수 있습니다> |
 |
<이미지를 클릭하시면 크게 보실 수 있습니다> |
[뉴스웨이 유수인 기자]
LG화학 생명과학사업본부가 신약 연구개발(R&D) 투자를 대폭 늘리면서 가시적인 성과도 나타나고 있다.
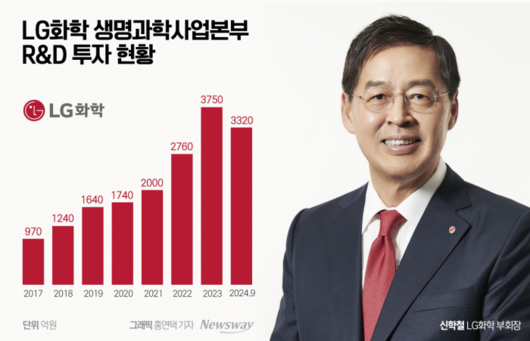
19일 LG화학에 따르면 생명과학사업본부는 올 3분기까지 3320억원에 달하는 비용을 R&D에 투자했다. 이는 지난해 연간 R&D비용(3750억원)의 약 88%에 달하는 금액이다. 전년 동기 2690억원에 비교하면 23.4% 증가했다.
LG화학 생명과학사업본부는 매년 R&D 비용을 큰 폭으로 늘리고 있다. 연도별로 보면 2017년 970억원에서 ▲2018년 1240억원 ▲2019년 1640억원 ▲2020년 1740억원 ▲2021년 2000억원 ▲2022년 2760억원으로 급증했다.
지난해엔 1월 인수한 미국 항암신약 기업 '아베오 파마슈티컬스'(아베오)의 비용이 합쳐지며 숫자는 더 늘었다.
R&D 투자 확대는 신약 개발 성과로 이어지고 있다. 현재 글로벌 임상3상 중인 경구용 통풍 신약 '티굴릭소스타트'는 최근 톱라인(Top-line) 데이터에서 처음으로 효능을 입증했다. 톱라인 데이터는 임상 최종 결과를 발표하기 전 먼저 공개하는 일부 핵심 지표로, 사실상 임상 성공 여부 미리 가늠할 수 있는 데이터다.
'티굴릭소스타트'의 임상 프로젝트는 '유렐리아1 스터디', '유렐리아2 스터디' 등으로 구분해 미국과 유럽 등에서 진행 중인데, 이번에 효과가 확인된 데이터는 '유렐리아1 스터디'다. 유렐리아1 스터디는 티굴릭소스타트와 위약을 비교해 혈중 요산 강하 유효성 및 안전성을 평가하는 시험이다.
이번에 효과를 확인한 임상은 지난 2022년부터 전 세계 4개국 55개 기관에서 고요산혈증을 동반한 통풍 환자 353명을 대상으로 진행했다.
일차평가변수는 임상약을 6개월간 투여한 후 마지막 연속 3개월간(4,5,6개월)의 혈청 요산(sUA) 수치가 6mg/dL 미만을 보였는지다. 임상 결과, 티굴릭소스타트 투여군에서는 평균 48% 환자가 6mg/dL 미만을 달성해 위약군 2% 대비 통계적으로 유의한 효과를 기록했다
안전성 지표에서도 티굴릭소스타트 투여군은 치료유발 이상 반응 비율이 45%로, 위약군 56%보다 낮았다. 이상 반응이 나타나더라도 대부분 경증 또는 중등증 수준을 보인 것으로 확인됐다.
중대한 치료유발 이상 반응은 두 약물 모두 2%씩 보고됐다. 다만 특별이상 반응은 티굴릭소스타트 투여군에서 약 1.7% 보고됐는데, 사망사례는 없었다.
앞서 회사는 지난해 1월 유럽에 신청한 유렐리아1 스터디를 자진 철회한 바 있다. 유럽 임상승인기관이 임상 디자인 수정 의견을 제시함에 따라 협의 후 재신청하기 위해서다. 지난 2022년 중국에서도 같은 이유로 임상 신청을 자진 취하했다.
임상 국가를 확장하는 이유는 시험자 모집을 신속히 하기 위한 목적이 크다. 이에 '티굴릭소스타트'의 글로벌 임상에 차질을 빚는 것 아니냐는 우려가 나오기도 했지만 미국에서 환자 모집과 임상이 빠르게 진행됨에 따라 상용화 기대감을 키울 수 있게 됐다.
LG화학 관계자는 "티굴릭소스타트는 1일 1회 경구복용 통풍치료제로써 환자들에게 새로운 치료제 선택의 기회를 제공해 줄 수 있을 것"이라며 "내년 말, 또 하나의 임상시험인 '유렐리아2 스터디' 결과를 확인해 사업화 일정을 구체화할 방침이다"라고 말했다.
'유렐리아2 스터디'는 기존 1차 선택 치료제 성분인 알로푸리놀을 대조군으로 하는 다국가 임상이다. 약 2600명의 고요산혈증 통풍 환자를 대상으로 하며, 2022년 11월 미국 식품의약국(FDA), 작년 2월 국내 식품의약품안전처로부터 임상3상 시험계획을 승인받아 임상을 진행하고 있다. 유럽에서도 조건부 승인을 받아 임상을 진행하고 있다.
글로벌 시장조사업체 그랜드뷰리서치에 따르면 전 세계 통풍 치료제 시장 규모는 2021년 3조원에서 연평균 16%씩 성장해 2025년 10조원대까지 몸집을 키울 것으로 전망된다.
이밖에도 회사는 백신, 대사질환, 항암 등 여러 분야에 투자를 늘리며 사업 역량을 확대하고 있다.
LG화학은 약 2000억원을 투자해 전량 수입에 의존하고 있는 영아용 혼합백신의 국산화를 추진하고 있다.
회사가 개발 중인 '정제 백일해(aP)' 기반 6가 혼합백신인 'LR20062'는 지난 8월 글로벌 임상2상에 돌입했다.
'LR20062'는 디프테리아, 파상풍, 백일해, 소아마비, B형헤모필루스인플루엔자, B형간염 등 6개 감염증을 예방한다. 국내에서 보편적으로 사용되는 5가 백신 대비 접종 횟수를 2회 줄일 수 있다.
임상 2상에서는 실제 백신 접종 대상자인 생후 2개월 이상의 영아 300여명을 시험자로 모집해 'LR20062'와 이미 상용화한 6가 혼합백신 간 안전성 및 면역원성을 비교 평가한다.
LG화학은 초기 연구 단계에 있는 항암치료백신 플랫폼의 기술이전 성과도 냈다.
회사는 최근 아크젠바이오사이온스에 'RP-TCV'의 글로벌 독점 개발 및 상업화 권리를 넘기는 항암치료백신 공동연구 및 라이선스 계약을 체결했다.
'RP-TCV'는 재조합 단백질 형태의 항암치료백신에 적용할 수 있는 기술이다. 항암치료백신은 환자의 면역 기전을 활용해 암을 치료하고 면역 기억 형성을 통해 재발을 방지할 수 있는 항암제로, 부작용이 적어 다양한 암종에 적용할 수 있고 기존 면역항암제와의 시너지 효과도 기대되는 치료제이다.
이번 계약으로 LG화학은 아크젠바이오사이온스로부터 계약금과 개발 단계별 마일스톤 및 로열티를 받게 된다. 계약 규모는 공개되지 않았으나 계약금은 올 4분기 재무제표에 반영될 전망이다.
회사측은 "현재 치료백신의 모달리티로 재조합단백질과 mRNA를 연구하고 있는데, mRNA쪽으로 연구 집중하기 위해 이번 기술이전 계약을 체결하게 됐다. 초기 연구단계에서 이전해 계약 규모는 크지 않다"고 설명했다.
희귀비만증 신약 'LB54640'은 지난 1월 미국 리듬 파마슈티컬스(이하 리듬)에 기술이전했다.
'LB54640'은 G단백 결합 수용체 일종인 MC4R(포만감 신호 유전자)을 표적으로 한 새로운 기전의 경구용 약물이다. 리듬은 지난 8월 'LB54640'의 임상 2상 첫 시험자 대상 투약을 개시하며 임상을 본격화했다.
유수인 기자 suin@
저작권자(c)뉴스웨이(www.newsway.co.kr). 무단전재-재배포금지
이 기사의 카테고리는 언론사의 분류를 따릅니다.
기사가 속한 카테고리는 언론사가 분류합니다.
언론사는 한 기사를 두 개 이상의 카테고리로 분류할 수 있습니다.
언론사는 한 기사를 두 개 이상의 카테고리로 분류할 수 있습니다.


