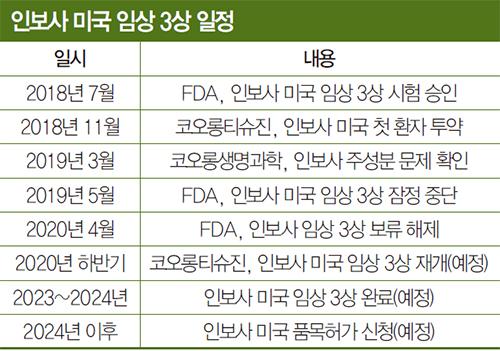
미국 FDA(식품의약국)는 지난 4월 11일 코오롱생명과학의 자회사 코오롱티슈진에 공문을 보내 ‘임상보류(Clinical Hold)’를 해제하고 환자 투약을 재개할 것을 허가했다. 이 공문에서 미 FDA는 “모든 임상보류 이슈들이 만족스럽게 해결됐다. 코오롱티슈진은 인보사의 임상시험을 진행해도 좋다”고 밝혔다.
이에 코오롱티슈진은 미 FDA가 지난해 5월 인보사 임상보류 결정을 한 지 11개월여 만에 임상을 재개할 수 있게 됐다. 코오롱 측은 이번 임상 재개와 관련해 “미 FDA가 코오롱티슈진이 이전까지 제출한 임상시험 데이터의 유효성을 인정한 것”이라며 “이를 기초로 형질전환된 신장유래세포(인보사2액)를 사용해도 좋다고 인정했다는 데 의미가 있다”고 설명했다.
 |
이번 미 FDA의 결정에서 주목할 점은 문제의 발단이 됐던 형질전환 신장유래세포를 통한 임상을 지정했다는 점이다. 국내에서는 종양 유발 가능성 등 많은 논란이 있었으나, 안정성 측면에서 별다른 문제가 없다는 미 FDA의 판단인 것으로 풀이된다.
코오롱티슈진은 임상시험 계획서와 임상시험 환자 동의서류 등에 대한 보완 절차를 마치는 대로 임상시험 환자 투약을 시작할 예정이다. 다만 현재 미국 내 코로나19가 기승을 부리고 있어 곧바로 임상 3상을 재개하기는 쉽지 않은 상황이다. 현실적으로는 코로나19가 잦아들고 난 이후 올해 말 즈음에나 임상 재개가 가능할 것으로 예상된다. 계획대로 연내에 임상이 다시 진행된다면 임상 완료에 이은 품목허가 신청은 2024년이 될 전망이다.
미국 임상 3상의 성공 여부는 인보사의 ‘연골 재생 효과’ 입증에 달려 있다는 분석이다. 인보사는 국내 품목허가 당시 연골 재생 효과 대신 ‘통증 완화 효과’만 인정받았다. 미국 임상에서는 관절조직의 구조적 개선 또는 질병 진행 억제로 근본적 치료(DMOAD·Disease-Modifying Osteoarthritis Drugs)를 입증할 계획이다.
코오롱티슈진은 미국 임상에 사활을 건다는 각오다. 만약 인보사가 미국 임상 3상에서 손상된 연골을 재생한다는 것을 입증하고 판매허가를 받을 경우 반전 드라마를 쓰는 것이 가능해진다. 식약처의 품목허가 취소를 놓고 진행 중인 행정소송에서도 유리한 위치에 설 가능성이 높다. 이 같은 긍정적인 전망에 코오롱생명과학 주가는 임상 재개 소식이 알려진 4월 13일 이후 3거래일 연속 상한가를 기록했다.
다만 인보사의 부활까지는 적잖은 난관이 남아 있어 마냥 기뻐할 수만은 없는 상황이다. 임상 완료까지는 최소 3~4년의 시간이 더 필요한 데다 환자들이 제기한 소송도 현재진행형이다. 인보사의 개발과 미국 현지 임상시험 등을 담당하고 있는 코오롱티슈진의 상장폐지 여부도 넘어야 할 장애물이다.
[류지민 기자 ryuna@mk.co.kr]
[본 기사는 매경이코노미 제2055호 (2020.04.22~04.28일자) 기사입니다]
[ⓒ 매일경제 & mk.co.kr, 무단전재 및 재배포 금지]
이 기사의 카테고리는 언론사의 분류를 따릅니다.
기사가 속한 카테고리는 언론사가 분류합니다.
언론사는 한 기사를 두 개 이상의 카테고리로 분류할 수 있습니다.
언론사는 한 기사를 두 개 이상의 카테고리로 분류할 수 있습니다.


